La décomposition dans les tourbières : qui intervient et sous quelle influence ?


Figure 1 : Exemple de réseau alimentaire simplifié dans le sol : Exemple d’un prédateur (A) Acarien prédateur ; Décomposeurs secondaires (B) Exemple d’acariens oribates (C) Exemple de collembole ; Décomposeurs primaires (D) Champignons (E) Champignons avec des bactéries en bas de l’image (ellipse) (F) Vers de terre (G) Végétation dans la tourbière (seules les plantes mortes sont décomposées). Les flèches représentent les relations alimentaires et indiquent la direction du flux d’énergie.

Figure 2 : (A) Tourbière (B) Butte devant un arbre (C) Dépression dans laquelle sont installés des sachets de litière (D) Sachets de litière (10 × 7 cm et mailles de 1 mm). (E) Mousse (espèce : Sphagnum sp.) (F) Arbrisseau (espèce : Chamaedaphne calyculata). (G) Carex ou Laîche (espèce : Carex sp.) (H) Entonnoir de Tullgren (extracteur de faune).
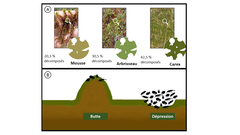
Figure 3 : (A) Différents niveaux de décomposition pour différents types de feuilles ; les carex se sont davantage décomposés pendant l’expérience d’un an. (B) Les dépressions contenaient plus d’espèces et d’individus d’acariens oribates et de collemboles. Les photos ne sont pas à l’échelle.
Open PDF in new window.
Carlos Barreto1*, Zoë Lindo1
1 Soil Biodiversity and Ecosystem Function Laboratory, Biotron Experimental Climate Change Research Centre, Department of Biology, Western University, London, ON, Canada
Tous les sols stockent du carbone. Pendant leur croissance, les plantes absorbent le carbone de l’atmosphère, puis ce carbone est transféré dans le sol lorsqu’elles meurent. Cette matière végétale morte se décompose lentement sous l’action d’organismes, comme des bactéries, des champignons et de minuscules animaux appelés acariens et collemboles, qui utilisent ce carbone comme source de nourriture. La décomposition est très lente dans les tourbières, et par conséquent, une grande partie du carbone des plantes mortes reste dans le sol, ce qui peut contribuer à ralentir le réchauffement climatique. La décomposition dans les tourbières dépend du degré d’humidité du sol et des différents types de végétaux et d’organismes qui y vivent. Dans une tourbière du nord du Canada, nous avons découvert que le matériel végétal mort de différents types de plantes se décomposait à des vitesses distinctes, et que l’on trouvait davantage d’acariens et de collemboles favorisant la décomposition dans les zones plus humides. Comme les tourbières sont importantes pour le stockage du carbone, il est nécessaire de connaître les acteurs de la décomposition pour comprendre comment ralentir le réchauffement climatique.
INTRODUCTION
La décomposition est le processus naturel de dégradation des plantes et des animaux morts. Pendant la décomposition, leur composition chimique change, ce qui entraîne la libération de carbone dans l’atmosphère. La décomposition résulte des activités de différents types d’organismes comme les champignons (Figure 1D), les bactéries (Figure 1E), les vers de terre (Figure 1F), les acariens du groupe des oribates (Figure 1B) et les collemboles (Figure 1C). Par exemple, les bactéries et les champignons décomposent directement le matériel végétal mort et sont ainsi considérés comme des décomposeurs primaires. Les champignons et les bactéries (décomposeurs primaires) sont mangés par les acariens oribates et les collemboles (décomposeurs secondaires). À leur tour, les acariens prédateurs (Figure 1A) consomment les décomposeurs secondaires. Par conséquent, les acariens oribates et les collemboles ont une influence indirecte sur la rapidité de la décomposition.
Les tourbières sont des écosystèmes importants qui accumulent la végétation partiellement décomposée (Figure 1G) et stockent ainsi le carbone contenu dans la matière végétale en décomposition [1] (Figure 2A). La végétation y est principalement constituée de mousses (Figure 2E). Les mousses sont de petites plantes à croissance lente qui ont besoin de beaucoup d’eau pour survivre, car elles n’ont pas de vraies racines. Elles se décomposent aussi très lentement dans les tourbières après leur mort. Les tourbières sont très humides et la décomposition y est lente par rapport à d’autres écosystèmes comme les forêts ou les prairies, qui sont plus sèches. Par conséquent, comme un plus grand nombre de plantes mortes s’accumulent, les tourbières libèrent moins de carbone dans l’atmosphère en comparaison à beaucoup d’autres types d’écosystèmes. Autrement dit, la quantité de carbone qui entre et qui est retenue dans les sols des tourbières est supérieure à celle qui est libérée dans l’atmosphère sous forme de dioxyde de carbone. Le dioxyde de carbone est un gaz à effet de serre qui piège la chaleur dans l’atmosphère terrestre. Les tourbières peuvent donc contribuer à ralentir ou à contrer le réchauffement climatique. Elles pourraient aider à lutter contre le changement climatique en stockant plus de carbone dans leur sol.
Différents facteurs peuvent influencer la décomposition dans les tourbières ; par exemple, le degré d’humidité du sol, les différents types de matériel végétal mort présents et la communauté du sol — les types des différents organismes vivant dans le sol. Comme nous voulions savoir ce qui influence la décomposition dans les tourbières, nous sommes allés dans la forêt boréale du nord de l’Ontario, au Canada, pour étudier les acariens et les collemboles qui vivent dans une magnifique tourbière. Nous avons étudié les communautés d’acariens et de collemboles vivant dans différentes zones de cette tourbière pour deux raisons : d’abord parce qu’on ne sait toujours pas quelles espèces d’acariens et de collemboles peuplent les communautés des tourbières, et aussi parce que nous voulions savoir dans quelle mesure ils pouvaient contribuer à la décomposition des feuilles.
QU’AVONS-NOUS FAIT ?
Notre groupe de chercheurs de l’Université Western (London, Ontario, Canada) travaille dans une tourbière du nord de l’Ontario (Canada) en collaboration avec des scientifiques du gouvernement provincial de l’Ontario de l’Institut de recherche forestière de l’Ontario. Nous essayons de répondre à différentes questions concernant les tourbières et pour cela, nous étudions les plantes, les acariens, les insectes, le mercure, le carbone et l’eau sur ce site. Cette tourbière est principalement recouverte de mousses du genre Sphagnum qui créent des buttes — zones surélevées — (Figure 2B) et des dépressions — zones en creux — (Figure 2C). Les buttes sont constituées d’une accumulation de mousses et d’autres plantes, et elles sont sèches en surface. En revanche, les dépressions sont généralement très humides en surface. Pour cette étude, nous voulions savoir si les communautés d’acariens et de collemboles (décomposeurs secondaires), de même que les taux de décomposition (vitesse à laquelle les plantes mortes se décomposent) différaient entre les buttes et les dépressions.
QU’AVONS-NOUS FAIT DANS LA TOURBIERE ?
Pour étudier la décomposition, on peut utiliser des sachets de litière. Les sachets de litière sont de petits sacs faits d’un matériau à mailles qui peuvent être remplis de plantes mortes ; les trous dans les mailles permettent aux petits organismes de rentrer et de sortir. Nous avons rempli les sachets de litière (Figure 2D) avec des feuilles de trois plantes différentes : de la mousse (Figure 2E), des arbrisseaux (Figure 2F) (ce sont de petits buissons) ou des feuilles de carex (Figure 2G) (ce sont des plantes ressemblant à de l’herbe), puis nous les avons pesés pour connaître la quantité initiale de feuilles sèches dans chacun d’entre eux.
En juin 2015, nous avons placé un sachet de litière de chaque type de plante (trois sachets de litière) sur cinq buttes différentes (zones sèches surélevées) et dans cinq dépressions différentes (creux humides). Les sachets de litière ont été fixés à la surface du sol et laissés sur place pendant une année entière afin que les organismes aient suffisamment de temps pour les coloniser et favoriser la décomposition des feuilles. Au bout d’un an, nous sommes retournés sur le site de la tourbière, nous avons collecté les sachets de litière et nous les avons rapportés dans notre laboratoire à l’Université Western, dans le sud de l’Ontario (Canada).
QU’AVONS-NOUS FAIT EN LABORATOIRE ?
Au laboratoire, nous avons placé chaque sachet de litière sur un équipement spécial appelé entonnoir de Tullgren (Figure 2H) qui contient une ampoule électrique. Celle-ci, lorsqu’elle est allumée, chauffe l’ensemble du sachet et en fait sortir les organismes qui tombent alors dans un petit flacon qui permet de les observer. Nous avons ensuite découpé les sachets de litière et séché les feuilles dans un four, puis nous les avons pesées avec une balance. Nous avons examiné au microscope les organismes collectés dans les sachets et nous les avons classés en différentes espèces en fonction de leur apparence. Nous avons également compté le nombre d’individus trouvés pour chaque espèce dans chaque sachet de litière. Cette partie du projet a mobilisé deux chercheurs qui ont travaillé sans arrêt pendant 5 jours entiers. Enfin, nous avons comparé la masse des feuilles de plantes qui ont passé 1 an sur notre tourbière, à leur masse initiale avant leur mise en place sur le site. La différence de masse nous a indiqué quelle quantité de feuilles s’était décomposée en 1 an, en d’autres termes, la quantité que les animaux avaient mangée.
QU’AVONS-NOUS TROUVE ?
Les feuilles des différentes plantes se sont décomposées à des vitesses différentes. Les feuilles de carex, qui ressemblent à des graminées (réduction de 42,5 %), se sont décomposées davantage que les feuilles d’arbrisseaux (réduction de 30,5 %), qui à leur tour se sont décomposées davantage que la mousse (réduction de 20,3 %) dans les sachets de litière (Figure 3A). Cependant, l’endroit où les sachets ont été mis en place a peu d’importance, car nous avons trouvé des quantités similaires décomposées aussi bien à la surface des buttes que dans les dépressions. En effet, même si les dépressions sont plus humides que les buttes, aucune n’était saturée au point de ralentir considérablement la décomposition dans nos sites, contrairement à d’autres parties submergées de la tourbière.
Un seul sachet de litière contenait entre zéro et 203 individus d’acariens et entre zéro et 123 individus de collemboles. Nous avons trouvé plus d’individus d’acariens et de collemboles dans les sachets placés dans les dépressions (zones en creux humides) que sur les buttes (zones sèches surélevées) (Figure 3B). Mais ces minuscules animaux n’avaient pas de préférence pour un type de feuille en particulier, ce qui signifie qu’on les trouvait en nombre similaire dans les sachets de litière qui contenaient des carex, des arbrisseaux ou des mousses. Certains acariens appelés acariens oribates (Figure 1B) constituaient le groupe dominant dans les sachets de litière (53,6 % du nombre total d’individus), suivis ensuite des collemboles, qui en représentaient 40 %. D’autres groupes d’acariens peu nombreux, quelques araignées et quelques larves d’insectes ont également été collectés, mais au total, ils ne représentaient que 6,4 % des animaux présents dans les sachets. Les dépressions (creux humides), non seulement contenaient plus d’individus, mais aussi plus d’espèces collectées. Au total, nous avons compté 506 individus pour 20 espèces d’acariens oribates et 378 individus (Figure 1C) pour sept espèces de collemboles. Les communautés d’acariens oribates se ressemblaient davantage et comptaient le plus d’espèces dans les dépressions. Les espèces d’acariens oribates trouvées dans les buttes semblaient être réparties au hasard.
POURQUOI EST-CE IMPORTANT ?
Il existe peu d’études sur les acariens et les collemboles dans les tourbières, c’est pourquoi nous avons d’abord réalisé cette étude pour obtenir des informations sur la nature des espèces d’acariens oribates qui vivent dans notre site. De plus, comprendre les différences entre les communautés de petits animaux donne une idée de la vitesse, rapide ou lente, à laquelle la décomposition des feuilles se produit normalement dans les tourbières.
Bien que dans la plupart des cas, les acariens oribates et les collemboles soient considérés comme des décomposeurs secondaires [3], car ils se nourrissent de champignons et de bactéries, il est important de comprendre qui ils sont, où ils vivent et dans quelle mesure ils contribuent aux processus de décomposition, afin de prédire la quantité de carbone libérée dans l’atmosphère par les sols. Les sols des tourbières sont un cas particulier, car les tourbières n’occupent qu’une petite surface dans le monde, mais leur décomposition lente implique une capacité de stockage de très grandes quantités de carbone [1].
L’augmentation des températures planétaires due au changement climatique devrait modifier les types de plantes que nous observons dans les tourbières. Plus précisément, des températures plus chaudes permettront aux carex de dominer dans les endroits où se trouvaient auparavant des mousses [4]. Dans notre étude, nous avons constaté que les carex se décomposaient plus rapidement que les mousses, ce qui signifie qu’un changement du type de plantes dans les tourbières, des mousses aux carex, peut augmenter la quantité de carbone libérée au cours de la décomposition.
Même si nous n’avons pas collecté de bactéries et de champignons dans cette étude précise, d’autres études menées par notre groupe de recherche dans la même tourbière ont révélé que les communautés de champignons [5] et de bactéries [6] différaient également entre les buttes et les dépressions. Les acariens et les collemboles sont moins étudiés, c’est pourquoi nous avons choisi de nous intéresser à eux. Les résultats concernant les champignons et les bactéries suggèrent également que le changement climatique pourrait modifier la capacité de stockage du carbone des tourbières. En d’autres termes, l’augmentation de la température pourrait accélérer la décomposition globale des feuilles, libérant ainsi davantage de dioxyde de carbone dans l’atmosphère et amplifiant encore le changement climatique. Néanmoins, nous devons nous investir dans la conservation des tourbières, car ce sont des écosystèmes importants pour nos vies futures qui seront probablement marquées par une plus grande quantité de dioxyde de carbone dans l’atmosphère. Il est temps de prendre des mesures de conservation !
GLOSSAIRE
Décomposition
Dégradation des plantes et des animaux morts mesurée par perte de matière.
Organisme
Un individu végétal, animal, bactérien ou fongique.
Changement climatique
Le changement climatique est le réchauffement du monde entier, principalement causé par l’augmentation des niveaux de dioxyde de carbone dans l’atmosphère. Les activités humaines sont la principale source de dioxyde de carbone.
Tourbières
Les tourbières sont un type de zones humides. Le terme « tourbière » désigne le sol tourbeux et l’habitat de zone humide qui se développe à sa surface.
Espèce
Organismes qui partagent les mêmes caractéristiques physiques et génétiques ; par exemple, tous les humains constituent une espèce, de même que tous les chiens, tous les chats sont également considérés comme une espèce.
Communauté
Un groupe d’espèces différentes vivant et interagissant dans la même zone.
REMERCIEMENTS
Nous remercions le Conseil de recherches en sciences naturelles et en génie du Canada (CRSNG) pour son financement via le Programme de subventions à la découverte (ZL #418241-2012), ainsi que le ministère de la Recherche, de l’Innovation et des Sciences de l’Ontario pour l’attribution d’une bourse de nouveaux chercheurs (ZL). Nous remercions le Dr J. McLaughlin (Ministère des Richesses naturelles et des Forêts de l’Ontario) pour l’accès au site de White River, ON, ainsi que le Dr Brian Branfireun. Tous deux ont apporté un soutien constant à notre programme de recherche. Nous remercions le Dr Greg Thorn et le Dr Branfireun d’avoir fourni certaines photos. Nous remercions tout particulièrement Caitlyn Lyons, qui nous a aidés à adapter notre vocabulaire pour les enfants, ainsi que nos fantastiques jeunes relecteurs et leurs conseillers scientifiques. Nous remercions également le Dr Malte Jochum de nous avoir invités à participer à cette formidable initiative.
PUBLICATION SCIENTIFIQUE ORIGINALE
Barreto, C., and Lindo, Z. 2018. Drivers of decomposition and the detrital invertebrate community differ across a hummock-hollow microtopology in Boreal peatlands. Ecoscience 25:39–48. doi: 10.1080/11956860.2017.1412282
RÉFÉRENCES
[1] Gorham, E. 1991. Northern peatlands: role in the carbon cycle and probable responses to climatic warming. Ecol. Appl. 1:182–95.
[2] Moore, T. R., Trofymow, J. A., Prescott, C. E., and Titus, B. D. 2017. Can short-term litter-bag measurements predict long-term decomposition in northern forests? Plant Soil 416:419–26. doi: 10.1007/s11104-017-3228-7
[3] Lehmitz, R., and Maraun, M. 2016. Small-scale spatial heterogeneity of stable isotopes signatures (d15N, d13C) in Sphagnum sp. transfers to all trophic levels in oribatid mites. Soil Biol. Biochem. 100:242–51. doi: 10.1016/j.soilbio.2016.06.005
[4] Dieleman, C. M., Branfireun, B. A., Mclaughlin, J. W., and Lindo, Z. 2015. Climate change drives a shift in peatland ecosystem plant community: implications for ecosystem function and stability. Glob. Change Biol. 21:388–95. doi: 10.1111/gcb.12643
[5] Asemaninejad, A., Thorn, R. G., and Lindo, Z. 2017. Vertical distribution of fungi in hollows and hummocks of boreal peatlands. Fungal Ecol. 27:59–68. doi: 10.1016/j.funeco.2017.02.002
[6] Asemaninejad, A., Thorn, R. G., Branfireun, B. A., and Lindo, Z. 2019. Vertical stratification of peatland microbial communities follows a gradient of functional types across hummock-hollow microtopographies. Ecoscience 26:249–58. doi: 10.1080/11956860.2019.1595932
ÉDITEUR : Malte Jochum
CITATION : Barreto C and Lindo Z (2020) Decomposition in Peatlands: Who Are the Players and What Affects Them? Front. Young Minds 8:107. doi: 10.3389/frym.2020.00107
CONFLIT D’INTÉRÊTS : Les auteurs déclarent que ces recherches ont été menées en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
CONTRIBUTIONS DES AUTEURS : CB et ZL ont rédigé le manuscrit et CB a conçu les figures.
COPYRIGHT © 2020 Barreto and Lindo. Cet article est en accès libre selon les termes de la licence Creative Commons Attribution (CC- BY). Son utilisation, sa distribution ou sa reproduction par tous moyens et sous tous formats est autorisée, à condition que le(s) auteur(s) original (aux) et le(s) titulaire(s) du droit d’auteur soient crédités, et que la publication originale dans ce journal soit citée, conformément aux pratiques académiques acceptées. Toute utilisation, distribution ou reproduction non conforme à ces conditions est interdite.
JEUNES RELECTEURS
ADAM, ÂGE : 14 ANS
Bonjour, je m’appelle Adam. Je vis avec mes parents, mon frère aîné, un chien, un poisson et deux oiseaux. Je suis un grand fan de Sciences et d’Histoire. J’aime dessiner, écrire et lire. Mon sport préféré est le football. J’aime nager dans l’océan et jouer aux jeux vidéo.
ALEXANDER, ÂGE : 12 ANS
Je suis un garçon de 12 ans, je suis en cinquième, et ma matière préférée, c’est les mathématiques. J’aime jouer de la guitare et j’apprends à jouer de la batterie.
AUTEURS
CARLOS BARRETO
Depuis tout petit, je me suis rendu compte que j’aimais les animaux, peut-être trop. À l’école, les sciences ont toujours été ma matière préférée, jusqu’au lycée. C’est à ce moment-là que j’ai décidé que je voulais faire un métier qui impliquerait la science et les animaux. J’ai essayé d’être vétérinaire ; ça n’a pas marché. Pas de regrets. Je suis donc devenu écologue quelques années plus tard, et depuis, j’ai travaillé avec de petits animaux (principalement des insectes et des acariens) dans des forêts tropicales, des grottes dans le minerai de fer et le calcaire, des forêts boréales, des espaces verts urbains et des tourbières sur trois continents ; l’Amérique du Sud, l’Amérique du Nord et l’Europe. *cbarreto@uwo.ca †orcid.org/0000-0003-2859-021X
ZOË LINDO
Dr Zoë Lindo est une spécialiste de la biodiversité des sols et des fonctions des écosystèmes. Elle a beaucoup travaillé sur les forêts canadiennes, notamment la forêt boréale mixte de l’Alberta, la taïga subarctique du Québec, la forêt pluviale tempérée côtière de la Colombie-Britannique et les épinettes noires/tourbières de l’Ontario. « Mes recherches ont pour objectif général d’atténuer la perte de biodiversité liée au changement environnemental causé par l’homme et de maintenir le fonctionnement des écosystèmes dans les forêts et les sols canadiens. Je me définis comme une “chercheuse en biodiversité” afin de couvrir tout le champ de mes recherches dans les domaines de l’écologie des communautés, de l’écologie du sol et de la taxonomie. » †orcid.org/0000-0001-9942-7204
TRADUCTRICE
ANNE GALLET-BUDYNEK
Je suis traductrice, ingénieure et docteure en agronomie ; j’ai eu la chance d’effectuer des recherches pendant plusieurs années sur le cycle des éléments minéraux dans les écosystèmes terrestres, en France et à l’étranger. https://www.linkedin.com/in/anne-gallet-budynek-9a089450/
